Calor Latente |
| Quando uma quantidade de calor é fornecida ou retirada de um corpo, não modifica a suatemperatura, mas produz mudança de seu estado de agregação ou mudança fase, é denominado calor latente. |
 | 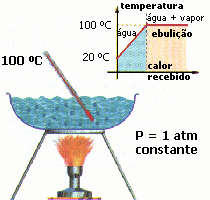 | |
| Na transformação do gelo em água, embora o gelo esteja recebendo calor, sua temperatura não varia enquanto não se completa a mudança de fase | Na transformação da água em vapor, embora a água esteja recebendo calor, sua temperatura não varia enquanto não se completa a mudança de fase | |
| Essa temperatura invariável denominamos de temperatura de mudança de fase. O calor específico latente L de um material informa a quantidade de calor que uma unidade de massa desse material precisa receber ou perder exclusivamente para mudar de estado de agregação. A quantidade de calor é determinada através da seguinte expressão: Q = m . |
Mudanças de Estados
- A troca de calor entre materiais, ou seja, propagação de energia térmica, pode causar mudanças nos materiais que trocam energia. As principais mudanças que podem ocorrer num material devido à variações de sua energia térmica são: variação da temperatura, variação de volume e mudança de estado físico.
- Todos os materiais são formados por moléculas (menor parte da matéria que conserva as característica de uma substância), sendo que a maioria dos materiais que encontramos na natureza são formados pela mistura de diferentes substâncias. O efeito do aumento de energia térmica num material é o aumento da velocidade com que as moléculas se movem (vibram) no material. O aumento de temperatura se dá por que a temperatura que sentimos é um indicativo da energia cinética com que as moléculas estão vibrando, ou seja, o quão rápido as moléculas estão se movimentando. O estado físico de um material, sólido, líquido ou gasoso, é devido à interação elétrica existente entre as moléculas das substâncias de que é formado o material. Com o aumento da energia térmica das moléculas, ou seja, com o aumento da intensidade com que vibram as moléculas, chega-se a uma certa temperatura onde a intensidade da vibração é suficiente para superar a interação molecular existente. Então ocorre a mudança de estado. As moléculas de um sólido vibram em torno de uma posição fixa; na mudança para o estado líquido as moléculas deixam de ter esta posição fixa de vibração, e com isso podem se deslocar de um lugar para outro. Na mudança do estado líquido para o gasoso, as moléculas deixam de ter interações entre si e passam a se movimentar para qualquer direção, se movendo pelo ambiente todo em que estiver o gás. A diminuição da quantidade de energia térmica simplesmente faz com que os mesmos fenômenos aconteçam, só que em ordem contrária.
- A idéia é usar parafina e provocar mudanças de estado: de sólido para líquido, de líquido para sólido e de líquido para gasoso. Primeiramente aquece-se um pedaço parafina, que é sólido, até que ocorra a mudança para o seu estado líquido. Depois deixa-se o líquido esfriar até que ele volte a ser sólido. Posteriormente aquece-se a parafina sólida até que haja a sua mudança para o estado líquido e, em seguida, gasoso.
| Item | Observações |
| Uma vela | para aquecer e retirar parafina |
| Caixa de palitos de fósforo | para acender a vela |
| Uma colher sopa | para colocar a parafina |
| Um estilete | para retirar da vela a parafina a ser derretida |
- Retire com o estilete cerca de três milímetros cúbicos de parafina do lado da vela.
- Coloque na colher a parafina que foi retirada.
- Acenda a vela e a fixe em algum lugar.
- Segure a colher logo acima da chama da vela.
- Espere a parafina derreter.
- Retire a colher de cima da chama e espere a parafina esfriar até voltar para o seu estado sólido.
- Volte a segurar a colher logo acima da chama da vela.
- Espere até que a parafina se decomponha, passando para o estado gasoso.
Nenhum comentário:
Postar um comentário